Säure Beurteilung
Frage: Säure Beurteilung(2 Antworten)
Wie kommen eigentlich die PKS-Werte zustande. Damit meine ich vor allem die unterschiedlichen PKS Werte. Wie PKS1 und PKS2 und PKS 3 Warum hat eine Säure 3 verschiedene PKS Werte? Hat das was mit der Temperatur zu tun? oder mit einem Stoff der dazutitriert wird? zB. Äpfelsäure: hat den PKS 1 Wert von 3,41 und PKS 2 Wert 5,14 offensichtlich geht es noch weiter bei PKS 3 . Wie ergeben sich diese verschiedenen Wertbezeichnungen? Pks 1PKS 2PKs 3PKS 5 ÄS 3,415,14---- Grüße WINTO |
| ANONYM stellte diese Frage am 03.05.2013 - 17:49 |
| Antwort von LsD | 03.05.2013 - 19:28 |
Hui, das sind viele Fragen zum Thema Säurestärke - aber eigentlich alle sehr einfach zu beantworten. Eine Säure kann ganz allgemein in der Regel ein Proton "H+" abgeben. Hier unterscheiden sich nun die starke und die schwache Säure. Eine starke Säure kann die entstehende negative Ladung prima stabilisieren und gibt daher "alle" Protonen sehr leicht und schnell ab und liegt dann als negativ geladener Rest vor. R-H <--> R(-) + H(+) Das ist aber immer ein Gleichgewicht, so dass der negativ geladene Rest auch jederzeit wieder ein H+ aufnehmen kann und zu R-H werden kann! Der PKS-Wert gibt hier an, was eher vorliegt: Die Säure (links) oder die deprotonierte Säure (rechts) 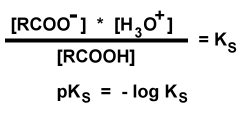 Ähnlich wie beim pH-Wert gilt auch hier: kleinerer Wert = stärkere Säure = liegt zu größerem Teil dissoziiert (als R- und H+) vor. Beim PKS2 betrachtet man dann entsprechend das Gleichgewicht für die Abgabe des zweiten Protons H-R-H <--> H-R(-) + H(+) ==== erstes Proton H-R(-) <--> R(--) + H(+) ==== zweites Proton Alles klar? ________________________ e-Hausaufgaben.de - Team |
| Antwort von WINTO (ehem. Mitglied) | 20.05.2013 - 19:32 |
Zunächst einmal Danke für Deine Bemühungen mir die Frage (von WINTO) über die PKS Werte zu beantworten. Ich versuche zunächst einmal mich in sie hineinzulesen. Doch ich hätte auch gerne gewußt warum ein und die selbe Säure, diese verschiedenen PKS-Werte hat. Also PKS1 und PKS2 und PKS 3 Was verändert sich da mit der Säure. (anderes Umfeld?) Teil der 1. Frage: Wie PKS1 und PKS2 und PKS 3 Warum hat eine Säure 3 verschiedene PKS Werte? Tut mir leid wenn ich jetzt nicht mit der Materie so vertraut bin, meine Chemie-Kenntnisse sind nicht die allerbesten. Grüße: Winto |
116 ähnliche Fragen im Forum:
> Du befindest dich hier: Support-Forum - Chemie- Säure-Basen-Reaktion (3 Antworten)
- Säure-Base-Reaktion eerklären. bitte (1 Antworten)
- Säure und saure Lösungen (4 Antworten)
- chemische reinigung eines wärmetauschers (3 Antworten)
- schwefel säure (1 Antworten)
- Weshalb können HC03 und HBr als Säure reagieren? (2 Antworten)
- mehr ...
ÄHNLICHE FRAGEN:
- Säure-Basen-ReaktionIch bin vollkommen am verzweifeln mit Chemie. Hab einen Arbeitsauftrag bekommen und ich tue mir echt schwer damit. Vielleicht ..
- Säure-Base-Reaktion eerklären. bitteSäure Basis Reaktion Beispiel: H(2) SO(4) + H(2) O—HSO(4)- + H(3)O+ 2=die Zahl kommt nach unten --=..
- Säure und saure Lösungenhttps://i.imgur.com/nSeA6UR.jpgHey , wir müssen das in Chemie machen und ich verstehe es überhaupt nicht :/ Könte mir jemand ..
- chemische reinigung eines wärmetauschersich habe eine ältere junkerscombitherme. der wärmetauscher ist stark verkalkt. möchte ihn mit ameisen säure reinigen. frage: ..
- schwefel säure3 schritte Darstellung von schwefel säure ( mit Reaktionsgleichung und besonderheiten und 8 Verwendunge von schwefelsäure sagen
- Weshalb können HC03 und HBr als Säure reagieren?Weshalb kann HC03- als Säure reagieren? Ich habe geantwortet kann als Säure reagieren, weil das Wasserstoffproton leicht ..
- mehr ...
BELIEBTE DOWNLOADS:
- Die NeutralisationChemischer Vorgang zwischen Säure und Lauge. Mit Beispielen und Reaktionsgleichungen.
- Redox-, Säure-Base- und Nachweisreaktionen, GK 12 Klausur HessenKlausur des Chemie GK 12/1 über die Themen Redox-Reaktionen, Säure-Base-Reaktionen und Nachweisreaktionen(Kaliumpermanganat, ..
- Das PuffersystemBeschreibung des Puffersystems Gliederung 1. Was ist ein Puffer 2. Zusammensetzung 3. Einsatz 4. Wo kommen sie vor +..
- ProtolyseIn dieser Arbeit geht es um das Wesen der Protolyse, alles was du schon immer wissen wolltest über die Protolyse (kurz und knapp..
- Säurekatalysierte VeresterungEin kleines Referat über Ester im allgemeinen, und über die Synthese von Estern mit konz. H2SO4 als Katalysator im Speziellen. ..
- EssigsäureDieses Referat über Essigsäure stammt aus dem Fach Chemie. Es sind folgende Themen enthalten: Essigsäure Eigenschaften, Herkunft..
- mehr ...

 1563
1563