Carbonsäuren - Eigenschaften..
Frage: Carbonsäuren - Eigenschaften..(6 Antworten)
zusammenfassung einiger punkte.. ___________________ |
| GAST stellte diese Frage am 12.01.2010 - 22:29 |
| Antwort von KrissiBerlin | 12.01.2010 - 22:30 |
hahahah |
| Antwort von GAST | 12.01.2010 - 22:31 |
Die kurzkettigen Alkansäuren sind wie die Alkohole sehr gut wasserlöslich, da ihr Molekül stark polar ist. Die Moleküle können untereinander, aber auch mit Wasser-Molekülen Wasserstoffbrücken-Bindungen ausbilden (vgl. >Ethanol). 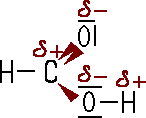 _________________ Im Vergleich zu den Alkoholen liegen aufgrund der höheren Polarität die Siedepunkte noch höher. Die kurzkettigen Alkansäuren bilden sogenannte Dimere, zwei Moleküle, die sich aufgrund der Polarität über Wasserstoffbrücken-Bindungen anziehen: 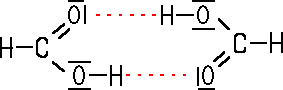 |
| Antwort von GAST | 12.01.2010 - 22:32 |
Mit zunehmender Kettenlänge nehmen aufgrund der steigenden Van-der-Vaals-Kräfte die Siedepunkte zu, während die Wasserlöslichkeit sinkt. Die Pentansäure ist nur noch schlecht wasserlöslich, während die Octansäure im Wasser gar nicht mehr löslich, dafür aber gut in unpolaren Lösungsmitteln wie Benzin löslich ist. 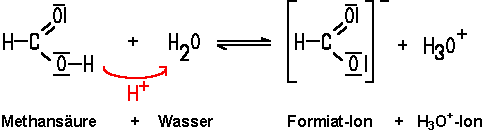 Die Säurewirkung der Carbonsäuren beruht auf einer Säure-Base-Reaktion. Ein Proton der Carboxy-Gruppe kann aufgrund der hohen Polarität leicht abgegeben werden. Es entsteht das für die Säuren typische H3O+-Ion. Mit zunehmender Kettenlänge hebt der Alkylrest die polare Wirkung wieder auf, so dass das Proton schwerer abgespalten wird. Die Säurestärke nimmt daher mit zunehmender Kettenlänge ab, Buttersäure ist nur noch eine relativ schwache Säure. Die Säurewirkung der Carbonsäuren kann mit einem Indikator gemessen werden. Bei der Reaktion einer Carbonsäure mit einem unedlen Metall, entstehen unter Wasserstoffentwicklung die Salze der Carbonsäure. Bei der Reaktion von Ameisensäure mit Magnesium erhält man unter stürmischer Wasserstoffentwicklung Magnesiumformiat: Ameisensäure + Magnesium -----> Magnesiumformiat + Wasserstoff |
| Antwort von brabbit | 12.01.2010 - 22:33 |
Danke. Kommt aber ein Jahr zu spät  ________________________ e-Hausaufgaben.de - Team |
| Antwort von GAST | 12.01.2010 - 22:34 |
Einige der Salze werden als Lebensmittel-Zusatzstoffe eingesetzt. Die Natrium- und Kaliumsalze der langkettigen Carbonsäuren nennt man Seifen (z.B. Natriumstearat). z.B. Ameisensäure -> Formiate (Name des Salzes) -> als Lebensmittel-Konservierung Essigsäure -> Acetate (Name des Salzes) -> als Lebensmittel-Konservierung |
| Antwort von GAST | 12.01.2010 - 22:40 |
Name des Kohlenwasserstoffs, der bei der Oxidation formal die Carbonsäure ergeben würde + Endung „Säure“, z.B. Ethansäure hohe Siedepunkte, z.B. Methansäure 100°C; Ethansäure 118°C Ursache: Dimerisierung unter Ausbildung von Wasserstoffbrücken:  Wasserlöslichkeit: Nur die ersten vier der homologen Reihe sind unbegrenzt mit Wasser mischbar ____________________________________________ Allgemein hängt die Acidität einer organischen Verbindung R–H von folgenden Faktoren ab: 1. Von der Elektronegativität des Atoms, an welches das H-Atom gebunden ist. Ethan hat z.B. einen pKs-Wert im Bereich von 60, während Ethanol einen pKs von ~ 16 aufweist. 2. Von der Möglichkeit die negative Ladung des Anions R– zu stabilisieren. Der pKs-Wert von Essigsäure liegt bei 4,8. Der Grund für die hohe Acidität der Essigsäure liegt in der Stabilisierung der negativen Ladung im Carboxylat-Ion (Mesomerie). |
77 ähnliche Fragen im Forum:
> Du befindest dich hier: Support-Forum - Chemie- Carbonsäuren (1 Antworten)
- Doppelmoleküle: Alkohol / Aldehyde <----> Carbonsäuren ? (4 Antworten)
- Stoffe und ihre Eigenschaften (4 Antworten)
- Collagen, Keratin, Seide, Wolle: Eigenschaften und Struktur (1 Antworten)
- Protolyse (1 Antworten)
- Carbonsäuren - Arbeit ! (1 Antworten)
- mehr ...
ÄHNLICHE FRAGEN:
- CarbonsäurenWarum sind Carbonsäuren sauer? Wie stellt man eine Protolyse Reaktion auf?
- Doppelmoleküle: Alkohol / Aldehyde <----> Carbonsäuren ?Doppelmoleküle : Hallo , Können Alkohol oder Aldehyde auch Doppelmoleküle ausbilden wie Carbonsäuren ? Und ..
- Stoffe und ihre EigenschaftenWie könen eigenschaften ermittelt werden? wenn es jemand weis kann er mir es sagen pls :S
- Collagen, Keratin, Seide, Wolle: Eigenschaften und StrukturHat jemand dazu die Eigenschaften und woran man diese an der Strukur ablesen kann?
- ProtolyseWie stellt man eine Protolyse Reaktion auf? Warum sind Carbonsäuren sauer?
- Carbonsäuren - Arbeit !Hallo, ich würde gerne von euch die Antworten wissen, ich war nämlich die letzten Wochen leider nicht in der Schule. Danke ..
- mehr ...
BELIEBTE DOWNLOADS:
- Carbonsäuren und ihre DerivateChemiereferat über Carbonsäuren und ihre Derivate: 1)Carbonsäuren 2)gesättigte Carbonsäuren oder Alkansäure 3)ungesättingte ..
- Eigenschaften der Elemente in verschiedenen HauptgruppenEs geht um die Eigenschaften der Alkali- und Erdalkalimetalle, sowie um verschiedene andere Hauptgruppenelemente und deren ..
- Eigenschaften und Nachweiss von EiweißenKurzes Referat, ca.5 min, über die Eigenschaften und Nachweiss der Eiweiße. Die Aufgabenstellung ist die selbe.
- Chemiefasern - Grundlage für TextilindustrieChemie- Facharbeit mit dem Titel "Chemiefasern - Grundlage für Textilindustrie". Gliederung: 1 Einleitung 3 2 Entwicklung der ..
- Saurer Regen: Entstehung, Eigenschaften und AuswirkungenEs geht um die Entstehung, die Eigenschaften und die Folgen von saurem Regen.
- MethanalZusammenfassung über Methanal, seine Eigenschaften, seine Einsatzgebiete und sein Vorkommen. Quelle: Tausch/von Wachtendonk (..
- mehr ...
