Reaktionsprozesse von Blei- und Lithiumionenakkus
Frage: Reaktionsprozesse von Blei- und Lithiumionenakkus(11 Antworten)
Hallo , İch hätte ein paar Fragen zum Lithiumionenakku und zum Bleiakku . man mehrere Reaktionen hat bzw. 2 Oxidations und 2 Reduktionsprozesse . Leider verstehe ich das nicht und brauche Hilfe . Wieso hat man nicht 1Reaktionsgleichung für die Entladung und 1 für die Ladung , sondern 2Gleichungen je Vorgang ? Bitte auf eine einfache Erklärung und keine riesen Texte . |
| Frage von Sanane11 | am 15.10.2014 - 16:14 |
| Antwort von cir12 | 16.10.2014 - 17:50 |
Auch beim Lithiumionen-Akku laufen elektrochemische Vorgänge ab. Die folgenden Vorgänge stehen für den Entladevorgang: Oxidation an der negativen Elektrode: LixCn --> n C + x Li+ + x e- Reduktion ander positiven Elektrode: Li1-xMn2O4 + x Li+ + x e- --> LiMn2O4 Beide Reaktionen zusammengefasst in einer Redox-Gleichung, Li1-xMn2O4 + LixCn --> LiMn2O4 + n C Nun noch kurz zu dem „Polwechsel“ und den Begriffen „Kathode“und „Anode: Wenn Du eine Elektrolyse durchführst, dann kommen die Elektronen vom Minuspol der Stromquelle, der Kathode und werden vom Pluspol der Stromquelle,der Anode angesaugt. In der Halbzelle des Elektrolysiergefäßes, die mit der Kathode (dem Minuspol) verbunden ist, läuft die Reduktion ab. In der anderenHalbzelle (sie ist mit dem Pluspol verbunden) läuft die Oxidation ab. Nun wird aber die Stromzufuhr gestoppt und die beiden Halbzellen kurzgeschlossen. Jetzt liegt ein galvanisches Element vor. Wo vorher die Reduktion ablief, läuft jetzt die Oxidation ab, wo vorher die Oxidation ablief, läuft jetzt die Reduktion ab. Die Elektronen kommen jetzt von der Anode (diese ist jetzt der Minuspol) und wandern zur Kathode (hier ist jetzt derPluspol). |
| Antwort von cir12 | 15.10.2014 - 17:33 |
Bei den Akkus laufen Redoxprozesse ab. Man kann nun in je einer Gleichung den Oxidationsprozess bzw. den Reduktionsprozess formulieren. Man kann aber auch beide Vorgänge in einer Gleichung darstellen. Für den Bleiakku kämen die folgenden Gleichungen in Frage: Bei der Entladung laufen folgende chemische Vorgänge ab: a)Negativer Pol: Hier läuft die Oxidation ab  b) Positiver Pol: Hier läuft die Reduktion ab 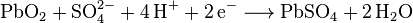 c) Gesamtreaktion beim Entladen:  Beim Ladevorgang laufen die Vorgänge in Gegenrichtung ab. |
| Antwort von Sanane11 | 15.10.2014 - 18:07 |
Danke , Jedoch habe ich weniger Probleme mit dem Bleiakku als mit dem Lithium ionen akku , bei der 2. verstehe ich nicht wie ich vorgehen muss , wenn ich nur eine unbeschriftete Abbildung des Vorgangs habe und diese aber mit Reaktionsgleichungen erklären soll . Wie gehe da vor ? Ich kenne zwar das Prinzip ( Lithiumionen werden hin und her geschoben und es kommt zur Anlagerung in Graphitschichtzwischenräumen und xur Verbindung mit dem Metalloxid ( z.B. CoO2)). Fakt ist ich weiss nicht wieso ich wie vorgehe ... |
| Antwort von cir12 | 15.10.2014 - 19:32 |
So ganz verstehe ich Dein Problem doch nicht. Eine nicht beschriftete Abbildung des Lithiumionenakku kann man nicht mit Gleichungen beschreiben. Wenn Dein Problem aber ähnlich ist wie beim Bleiakku, dann hilft Dir vielleicht der folgende Link weiter: http://www.chemieunterricht.de/dc2/echemie/li-ion-b.htm |
| Antwort von Sanane11 | 16.10.2014 - 16:28 |
Okey , dann Frage ich mal was anderes . Warum gibt es einen Polwechsel beim Entladen und Laden ? Und wieso muss man 2 reaktionsgleuchungen für die Entladung ( Verlauf Anode und Verlauf Kathode) Und 2 reaktionsgleuchungen für die Ladung aufstellen ? Beim Lithium Ionen Akku handelt es sich ja nur um das hin und herwandern von Elektronen von dem Metalloxidgitter zum Graphitgitter und anders herum . |
| Antwort von matata | 16.10.2014 - 16:48 |
http://de.wikipedia.org/wiki/Elektrischer_Pol ---> Warum haben Batterien oderAkkus einen Plus- und Minuspol? http://www.elektronikinfo.de/strom/akkus.htm ---> Grundsätzliches zu Akkumulatoren http://www.seilnacht.com/Lexikon/e_batt.htm ---> Grundsätzliches zu Batterien und Akkus http://de.wikipedia.org/wiki/Lithium-Ionen-Akkumulator http://www.youtube.com/watch?v=cXp38RjzIVA ---> Lernvideo ---> Ladung und Entladung eines Akkus ________________________ e-Hausaufgaben.de - Team |
| Antwort von Sanane11 | 16.10.2014 - 17:09 |
Also ich hab mir die ganzen Seiten durchgelesen und auch das Video gekuckt . Aber ich weiß immernoch nicht wieso - und Pluspol wechseln .... Außerdem Suche ich immer erst im Internet nach den Antworten auf meine Fragen und schreibe sie erst dann auf wenn ich nicht weiterkomme . |
| Antwort von matata | 16.10.2014 - 17:44 |
Das ist gut, dass du dich selber so stark bemühst, und das anerkenne ich auch. Wiki liefert die Lösung auf deine Frage: Zitat: ________________________ e-Hausaufgaben.de - Team |
| Antwort von cir12 | 16.10.2014 - 17:50 |
Auch beim Lithiumionen-Akku laufen elektrochemische Vorgänge ab. Die folgenden Vorgänge stehen für den Entladevorgang: Oxidation an der negativen Elektrode: LixCn --> n C + x Li+ + x e- Reduktion ander positiven Elektrode: Li1-xMn2O4 + x Li+ + x e- --> LiMn2O4 Beide Reaktionen zusammengefasst in einer Redox-Gleichung, Li1-xMn2O4 + LixCn --> LiMn2O4 + n C Nun noch kurz zu dem „Polwechsel“ und den Begriffen „Kathode“und „Anode: Wenn Du eine Elektrolyse durchführst, dann kommen die Elektronen vom Minuspol der Stromquelle, der Kathode und werden vom Pluspol der Stromquelle,der Anode angesaugt. In der Halbzelle des Elektrolysiergefäßes, die mit der Kathode (dem Minuspol) verbunden ist, läuft die Reduktion ab. In der anderenHalbzelle (sie ist mit dem Pluspol verbunden) läuft die Oxidation ab. Nun wird aber die Stromzufuhr gestoppt und die beiden Halbzellen kurzgeschlossen. Jetzt liegt ein galvanisches Element vor. Wo vorher die Reduktion ablief, läuft jetzt die Oxidation ab, wo vorher die Oxidation ablief, läuft jetzt die Reduktion ab. Die Elektronen kommen jetzt von der Anode (diese ist jetzt der Minuspol) und wandern zur Kathode (hier ist jetzt derPluspol). |
| Antwort von Sanane11 | 16.10.2014 - 17:57 |
Also heisst das soviel wie ich muss schauen welche Seite eine niedrigere Spannung hat und der Stoff mit der niedrigeren Spannung ist der - pol? Wie muss ich das dann auf das Lithiumionenakku beziehen ? Bei diesem Akku gibt es beim Entladungsprozess einen Pluspol , da findet tie Reduktion statt , auf der Anderen Seite gibt es den + pol wo die Oxidation stattfindet. Aaaber beim Ladeprozess ist der + pol der Pol wo oxidiert wird und der - pol wo reduziert wird . Warum ändert sich das denn dann ? Muss ich wieder auf die Spannungsreihe schauen ? |
| Antwort von Sanane11 | 16.10.2014 - 17:59 |
okeyy , jetzt hab ichs glaub ich  |
| Antwort von Sanane11 | 16.10.2014 - 18:03 |
Ist das galvanische Element der Ladeprozess und die Elektrolyse der Entladeprozess ? |
17 ähnliche Fragen im Forum:
> Du befindest dich hier: Support-Forum - Chemie- Masse von Blei (2)-oxid berechnen:15 g Blei werden verbrannt (1 Antworten)
- Blei Akku (2 Antworten)
- Pbo-Bleioxid/Blei-II-Oxid: Teilchen- und Reaktionsgleichung? (2 Antworten)
- Periodensystem (1 Antworten)
- Bleioxid Reaktionsgleichung (4 Antworten)
- Elektrolyse und Bleiakkumulator: Beschreibung gesucht ! (1 Antworten)
- mehr ...
ÄHNLICHE FRAGEN:
- Masse von Blei (2)-oxid berechnen:15 g Blei werden verbranntberechne die masse blei(2)-oxid die bei der verbrennung von 15g blei entsteht! ich komme damit nicht klar wie die rechnung ..
- Blei AkkuHallo, versteht jemand diese Aufgaben: 1. Erklären Sie anhand der Nernstschen Gleichung, weshalb im winter häufiger ..
- Pbo-Bleioxid/Blei-II-Oxid: Teilchen- und Reaktionsgleichung?Wir haben heute in der Schule eine Aufgabe bearbeitet, die ich nicht verstanden habe : Statt Pbo2(die zwei ist kleingeschrieben..
- PeriodensystemBlei zeigt typische metallische Eigenschaften, Silicium nicht. Begründe mit dem Atombau
- Bleioxid ReaktionsgleichungIch muss ein Referat über Blei halten und komme bei der Reaktionsgleichung nicht weiter..die Teilchenebe e, wo man mit mol ..
- Elektrolyse und Bleiakkumulator: Beschreibung gesucht !HILFE! Schreibe morgen eine CHemiearbeit.. Kann mir jmd Die Elektrolyse und den Blei Akkumulator beschreiben?
- mehr ...
BELIEBTE DOWNLOADS:
- Die 4. Hauptgruppe im ÜberblickGemeinsame Eigenschaften, Herstellung und Verwendung der Kohlenstoffgruppe (4. Hauptgruppe im Periodensystem)
- mehr ...


